某实验小组用下列装置进行乙醇催化氧化的实验.(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式;(2)甲和乙两个水浴作用不相同,甲的作用是,乙的作用是;(3)下列反应原理可以用于检查司机是否酒后开车:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O(橙色) &n
2019-05-30
某实验小组用下列装置进行乙醇催化氧化的实验.
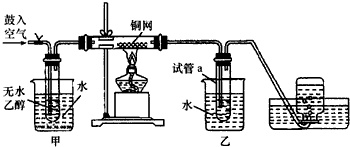
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式___;
(2)甲和乙两个水浴作用不相同,甲的作用是___,乙的作用是___;
(3)下列反应原理可以用于检查司机是否酒后开车:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (绿色)
①若司机酒后开车,应显示出___色;
②生成1mol Cr3+转移的电子数为___.

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式___;
(2)甲和乙两个水浴作用不相同,甲的作用是___,乙的作用是___;
(3)下列反应原理可以用于检查司机是否酒后开车:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (绿色)
①若司机酒后开车,应显示出___色;
②生成1mol Cr3+转移的电子数为___.