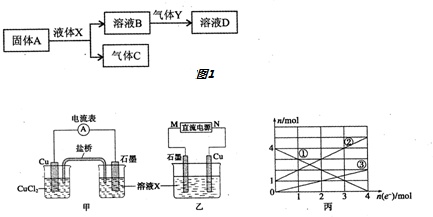
请根据H、O、Na、Si、S、Cl、Fe、Cu八种元素及其化合物,并用化学用语回答下列问题:(1)写出元素O的离子结构示意图.(2)写出元素Na与S形成化合物的电子式是.(3)写出元素O、Na、S的离子半径由大到小的顺序为.(4)写出元素Si、S、Cl最高价氧化物由强到弱的顺序为.(5)由上述部分元素组成的物质间,在一定条件下,可以发生如图1所示的变化,其中A是一种淡黄色的固体,请回答:①写出固体A与液体X反应的离子方程式.②Y是一种形成酸雨气体.可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应
2019-04-21
请根据H、O、Na、Si、S、Cl、Fe、Cu八种元素及其化合物,并用化学用语回答下列问题:
(1)写出元素O的离子结构示意图___.
(2)写出元素Na与S形成化合物的电子式是___.
(3)写出元素O、Na、S的离子半径由大到小的顺序为___.
(4)写出元素Si、S、Cl最高价氧化物由强到弱的顺序为___.
(5)由上述部分元素组成的物质间,在一定条件下,可以发生如图1所示的变化,其中A是一种淡黄色的固体,请回答:
①写出固体A与液体X反应的离子方程式___.
②Y是一种形成酸雨气体.可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D.已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为___.
(6)某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu.上述反应设计成的原电池如图甲所示,设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙.
①图中X溶液是___;
②原电池工作时,盐桥中的___(选填“K+”或“Cl-”)不断进入X溶液中
③图丙中的②线是___的变化.
④当电子转移2mol时,向乙烧杯中加入___L5mol•L-1NaOH溶液才能使有的金属阳离子沉淀完全.
(1)写出元素O的离子结构示意图___.
(2)写出元素Na与S形成化合物的电子式是___.
(3)写出元素O、Na、S的离子半径由大到小的顺序为___.
(4)写出元素Si、S、Cl最高价氧化物由强到弱的顺序为___.
(5)由上述部分元素组成的物质间,在一定条件下,可以发生如图1所示的变化,其中A是一种淡黄色的固体,请回答:
①写出固体A与液体X反应的离子方程式___.
②Y是一种形成酸雨气体.可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D.已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为___.
(6)某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu.上述反应设计成的原电池如图甲所示,设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙.
①图中X溶液是___;
②原电池工作时,盐桥中的___(选填“K+”或“Cl-”)不断进入X溶液中
③图丙中的②线是___的变化.
④当电子转移2mol时,向乙烧杯中加入___L5mol•L-1NaOH溶液才能使有的金属阳离子沉淀完全.

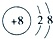 ,故答案为:
,故答案为: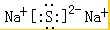 ,
,