煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1) 在煤的气化反应器中发生如下几种反应:C(s)十H 2 O(g)=CO(g)+H 2 (g) △H= +131kJ/molC(s)+O 2 (g)=CO 2 (g) △H= —394kJ/molCO(g)+ O 2 (g)=CO 2 (g)&n
2019-11-27
| 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1) 在煤的气化反应器中发生如下几种反应: C(s)十H 2 O(g)=CO(g)+H 2 (g) △H= +131kJ/mol C(s)+O 2 (g)=CO 2 (g) △H= —394kJ/mol CO(g)+ 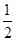 O 2 (g)=CO 2 (g) △H= —283kJ/mol O 2 (g)=CO 2 (g) △H= —283kJ/mol则CO(g)+H 2 O(g)  H 2 (g)+CO 2 (g)△H= H 2 (g)+CO 2 (g)△H= (2)已知830℃时,在一个容积固定的密闭容器中,发生反应 CO(g)+H 2 O(g)  H 2 (g)+CO 2 (g)下列能判断该反应达到化学平衡状态的是 (填字母)。 H 2 (g)+CO 2 (g)下列能判断该反应达到化学平衡状态的是 (填字母)。a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 mol H-O键 c. 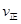 (CO)= (CO)=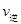 (H 2 O) d. c (CO)= c (H 2 ) (H 2 O) d. c (CO)= c (H 2 ) 又知此温度下该反应的平衡常数K=1,等物质的量的CO和H 2 O反应达到平衡时,CO的转化率为 . (3) 将不同量的CO(g)和H 2 O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应 CO(g)+H 2 O(g)  H 2 (g)+CO 2 (g),得到如下三组数据: H 2 (g)+CO 2 (g),得到如下三组数据: ①实验l中以  (CO 2 )表示的反应速率为 。 (CO 2 )表示的反应速率为 。②该反应的逆反应为 (填“吸”或“放’’)热反应 ③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。 (4)目前工业上有一种方法是用CO 2 来生产甲醇。一定条件下发生反应: 3H 2 (g)+CO 2 (g)  CH 3 OH(g)+H 2 O(g),右图表示 CH 3 OH(g)+H 2 O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。 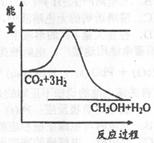 ①在体积为1 L的恒容密闭容器中,充入l molCO 2 和3molH 2 ,下列措施中能使 c (CH 3 OH)增大的是 (填字母) a.升高温度 b.充入He(g),使体系压强增大 c.将H 2 O(g)从体系中分离出来 d.再充入l mol CO 2 和3 molH 2 ②当反应达到平衡时不断改变条件(但不改变 各组分物质的量和状态且只改变一个条件)反应速率随时间的变化如右图:其中表示平衡混合物中CH 3 OH含量最高的一段时间是 ;如t 0 ~t 1 平衡常数为K 1 ,t 2 ~t 3 平衡常数为K 2 ,则K 1 K 2 (填“大于”、“等于”或“小于”)。  (5)煤气化过程中会生成少量CH 4 ,已知CH 4 与CaSO 4 反应生成CaS、CO 2 和H 2 O,该反应中氧化剂与还原剂的物质的量之比为 。 |