下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:族周期IA 01①ⅡAⅢAⅣAⅤAⅥAⅦA 2 ②③④ 3⑤ ⑥⑦ ⑧ (1)④、⑤、⑥的离子半径由大到小的顺序为用离子符号表示.(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是用化学式表示.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:.(4)由表中元
2019-04-21
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的离子半径由大到小的顺序为______用离子符号表示.
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______用化学式表示.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
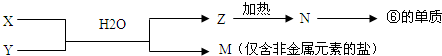
X溶液与Y溶液反应的离子方程式为______,N→⑥的单质的化学方程式为
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______用化学式表示.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
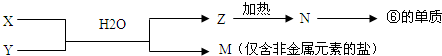
X溶液与Y溶液反应的离子方程式为______,N→⑥的单质的化学方程式为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
.
| ||
| 冰晶石 |
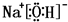 、
、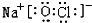 ,故答案为:
,故答案为: