(2011•山东)科研、生产中常涉及钠、硫及其化合物.(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为.要清洗附着在试管壁上的硫,可用的试剂是.(2)如图为钠硫高能电池的结构示意图.该电池的工作温度为200℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为.M(由Na2O和Al2O3制得)的两个作用是.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池倍.(3)Na2S溶液中离子浓度由达到小的顺序为,向该溶液中加入少量固体CuSO4,溶液pH(填“增大”、“
 (2011•山东)科研、生产中常涉及钠、硫及其化合物.
(2011•山东)科研、生产中常涉及钠、硫及其化合物.
(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为______.要清洗附着在试管壁上的硫,可用的试剂是______.
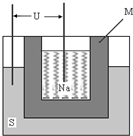
(2)如图为钠硫高能电池的结构示意图.该电池的工作温度为200℃左右,电池反应为
2Na+xS=Na2Sx,正极的电极反应式为______.M(由Na2O和Al2O3制得)的两个作用是______.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池______倍.
(3)Na2S溶液中离子浓度由达到小的顺序为______,向该溶液中加入少量固体CuSO4,溶液pH______(填“增大”、“减小”或“不变”). Na2S溶液长期放置有硫析出,是因为______(用离子方程式表示).
2019-06-24
 (2011•山东)科研、生产中常涉及钠、硫及其化合物.
(2011•山东)科研、生产中常涉及钠、硫及其化合物.(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为______.要清洗附着在试管壁上的硫,可用的试剂是______.
(2)如图为钠硫高能电池的结构示意图.该电池的工作温度为200℃左右,电池反应为
2Na+xS=Na2Sx,正极的电极反应式为______.M(由Na2O和Al2O3制得)的两个作用是______.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池______倍.
(3)Na2S溶液中离子浓度由达到小的顺序为______,向该溶液中加入少量固体CuSO4,溶液pH______(填“增大”、“减小”或“不变”). Na2S溶液长期放置有硫析出,是因为______(用离子方程式表示).