2019-11-25
【化学——选修 3 物质结构与性质】( 15 分)
A 、 B 、 C 、 D 、 E 、 F 为周期表中前四周期的六种元素,它们的原子序数依次增大,且均不同族。 A 、 B 、 C 三种元素的基态原子具有相同的能层和能级,且第一电离能 I 1 (A) < I 1 (C) < I 1 (B) , BC 2 + 与 AC 2 互为等电子体; D 、 E 为同周期相邻元素; F 元素位于 周期表中 1 ~ 18 列中的第 11 列。请回答下列问题(答题时请用相应的元素符号表示相应元素):
⑴ A 元素的价层电子排布图为 ; BC 2 + 的电子式为 ; 基态F原子的核外电子排布简式 。
⑵ E 元素的电离能情况如图 1 所示。 E 元素在周期表中位于 ; D元素单质 形成的
晶体晶胞类型属于 堆积。
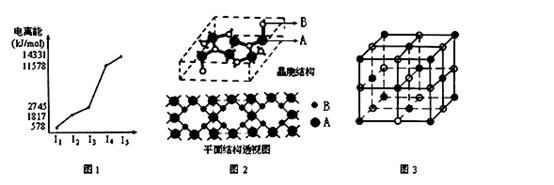
⑶ A 、 B 两元素所形成的化合物甲是首屈一指的超硬新材料,其晶胞结构如图 2 所示,由此可知,化合物
甲的晶体类型为 ,其硬度超过金刚石的原因是 。化合物甲的晶体中 B 原子的杂化方式为 。
⑷ D 、 C 两元素可形成的化合物乙。
① 现证实化合物乙的 晶体结构如图 3 所示,晶胞中 D 离子的配位数为 ;
② 设 D 离子半径分别为 a , C 离子半径分别为 b ,则其晶体的空间利用率为 。