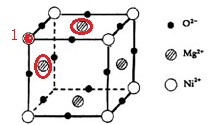
(2013•淄博二模)(1)写出Co2+离子基态的价电子排布式:.(2)SO32-的空间构型是:.(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:.(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化.该晶体中存在的作用力有:.(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示.在晶体中,每个Ni2+离子与个Mg2+离子配位.该晶体的化学式是.
 (2013•淄博二模)(1)写出Co2+离子基态的价电子排布式:______.
(2013•淄博二模)(1)写出Co2+离子基态的价电子排布式:______.
(2)SO32-的空间构型是:______.
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:______.
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化.该晶体中存在的作用力有:______.
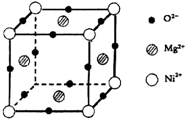
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示.在晶体中,每个Ni2+离子与______个Mg2+离子配位.该晶体的化学式是______.
2019-04-29
 (2013•淄博二模)(1)写出Co2+离子基态的价电子排布式:______.
(2013•淄博二模)(1)写出Co2+离子基态的价电子排布式:______.(2)SO32-的空间构型是:______.
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:______.
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化.该晶体中存在的作用力有:______.
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示.在晶体中,每个Ni2+离子与______个Mg2+离子配位.该晶体的化学式是______.