研究硫及其化合物的性质具有重要意义. (1)某学习小组同学将含硫物质分为如图1,3组,则第3组中,实验室里浓X试剂瓶上应贴的标签是(填序号)第1组第2组第3组S(单质)SO2、H2SO3、NaHSO3、Na2SO3SO3、X、NaHSO4、Na2SO4.(2)钠硫高能电池工作温度为320℃左右,电池反应式为:2Na+xS=Na2SX,则该电池的正极反应式为.(3)取6.4g铜片和15mL 16mol.L-1浓硫酸放在试管中加热,反应的化学方程式为 CuSO4+SO2↓+2H2O CuSO4+SO2↓+2H
,实验结束后,发现试管中还有铜片剩余,原因是___.2019-04-29
研究硫及其化合物的性质具有重要意义.
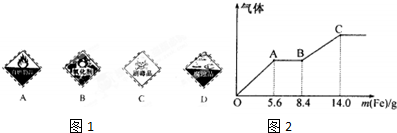
(1)某学习小组同学将含硫物质分为如图1,3组,则第3组中,实验室里浓X试剂瓶上应贴的标签是___(填序号)
.
(2)钠硫高能电池工作温度为320℃左右,电池反应式为:2Na+xS=Na2SX,则该电池的正极反应式为___.
(3)取6.4g铜片和15mL 16mol.L-1浓硫酸放在试管中加热,反应的化学方程式为__
_
(1)某学习小组同学将含硫物质分为如图1,3组,则第3组中,实验室里浓X试剂瓶上应贴的标签是___(填序号)
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、NaHSO3、Na2SO3 | SO3、X、NaHSO4、Na2SO4 |
(2)钠硫高能电池工作温度为320℃左右,电池反应式为:2Na+xS=Na2SX,则该电池的正极反应式为___.
(3)取6.4g铜片和15mL 16mol.L-1浓硫酸放在试管中加热,反应的化学方程式为__
(4)取一铜片和稀硫酸放入试管,再向其中滴加H2O2,发现溶液变蓝,反应的离子方程式为___.
(5)分别向100mL稀硫酸和稀硝酸的混合溶液中加入铜片和铁粉,其中一份最多溶解9.6gCu,而另一份随铁粉加入产生气体的量如图2所示,则OA段产生气体的离子方程式为___.稀硫酸物质的量浓度为___.