(选考)化学·选修3:物质结构与性质(15分)金属铝、铁、铜与人类生产、生活息息相关。 (1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3—n)/2]m,是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为。 (2)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3[AlF6]的说法中正确的有 (填字母)。 a.三种物质中含有的化学键类型均有离子键和配位键 b.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有大量分子 c.三种物质的组成
2019-05-22
(选考)化学·选修3:物质结构与性质(15分)金属铝、铁、铜与人类生产、生活息息相关。
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3—n)/2]m,是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为____________。
(2)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3[AlF6]的说法中正确的有_____ (填字母)。
a.三种物质中含有的化学键类型均有离子键和配位键
b.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有大量分子
c.三种物质的组成元素中第一电离能最大的是氮元素
d.K4[Fe(CN)6]与Na3[AlF6]的中心离子具有相同的配位数
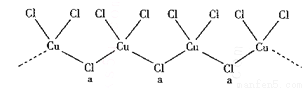
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上的Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为________。
(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9 00 g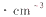 ,则铜原子的直径约为________pm,阿伏加德罗常数的值为_______.
,则铜原子的直径约为________pm,阿伏加德罗常数的值为_______.