三氯化硼(BCl3)是一种重要的化工原料.某兴趣小组拟选用下列装置(装置可重复使用),用氯气和硼制备BCl3(已知BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸).(1)装置A中反应的离子方程式.(2)上述装置连接顺序为ACF.(3)装置A中a管的作用是.装置B中饱和食盐水的作用.(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是.(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发
2019-11-27
三氯化硼(BCl3)是一种重要的化工原料.某兴趣小组拟选用下列装置(装置可重复使用),用氯气和硼制备BCl3(已知BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸).
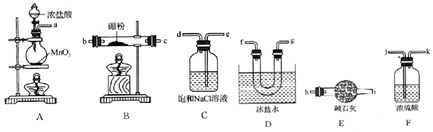
(1)装置A中反应的离子方程式___.
(2)上述装置连接顺序为A___C___F.
(3)装置A中a管的作用是___.装置B中饱和食盐水的作用___.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是___.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
表格中b值为___,通过实验得出的结论是___.

(1)装置A中反应的离子方程式___.
(2)上述装置连接顺序为A___C___F.
(3)装置A中a管的作用是___.装置B中饱和食盐水的作用___.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是___.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |