研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小.查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:①2NO(g)⇌N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) 
2019-12-02
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小.查阅资料知
2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)△H2<0
请回答下列问题:
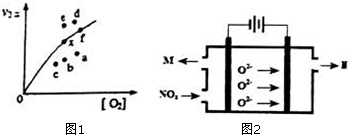
(1)反应2NO(g)+O2(g)⇌2NO2(g)的△H=___(用含△H1和△H2的式子表示).一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___,升高温度,K值___(填“增大”、“减小”或“不变”).
(2)决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”).
由实验数据得到v2正~c(O2)的关系可用图1表示.当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___(填字母).
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3•H2O=NH4NO3+NH4NO2+H2O.若反应后的溶液滴入甲基橙呈红色,则反应后溶液呈___性,且c(NH4+)___c(NO3-)+c(NO2-)(填“>”“<”或“=”).
(4)工业上也可用电解法处理氮氧化物(用NOX表示)的污染.电解池如图2所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-.该电解池阴极的电极反应式是___.阳极产生的气体N的化学式是___.
(5)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol•L-1)时,c(NO2-)=___.
2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)△H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)⇌2NO2(g)的△H=___(用含△H1和△H2的式子表示).一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___,升高温度,K值___(填“增大”、“减小”或“不变”).
(2)决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”).
由实验数据得到v2正~c(O2)的关系可用图1表示.当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___(填字母).
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3•H2O=NH4NO3+NH4NO2+H2O.若反应后的溶液滴入甲基橙呈红色,则反应后溶液呈___性,且c(NH4+)___c(NO3-)+c(NO2-)(填“>”“<”或“=”).
(4)工业上也可用电解法处理氮氧化物(用NOX表示)的污染.电解池如图2所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-.该电解池阴极的电极反应式是___.阳极产生的气体N的化学式是___.
(5)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol•L-1)时,c(NO2-)=___.