某校化学兴趣小组参观制碱厂后获得以下信息,并对相关问题进行研究。【查阅资料】 (1)资料1:该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为)和氯化铵。(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。)资料2:生产原料粗盐中含有少量可溶性杂质(MgCl 2 和CaCl 2 )及不溶性杂质。资料3:部分生产流程如下所示。 上述流程中涉及的部分反应的化学方程式为:MgCl 2 +2NaOH==Mg(OH) 2 ↓ +2NaCl;Na 2
2019-12-02
| 某校化学兴趣小组参观制碱厂后获得以下信息,并对相关问题进行研究。 | ||||||
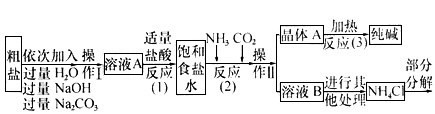 | ||||||
| 上述流程中涉及的部分反应的化学方程式为:MgCl 2 +2NaOH==Mg(OH) 2 ↓ +2NaCl;Na 2 CO 3 +CaCl 2 ==CaCO 3 ↓+2NaCl;NH 4 Cl==NH 3 ↑+HCl↑。生产原理:将氨气(NH 3 )和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH 3 +CO 2 +H 2 O==NaHCO 3 (晶体)↓+NH 4 Cl 4 分离出NaHCO 3 ,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为______________________________________________。 【问题讨论】(2)溶液A中的溶质为________,操作Ⅱ的名称为_____________。 (3)上述生产流程中可循环使用的是____ (填序号)。 A.CO 2 ;B.NH 3 ;C.HCl;D.NaOH;E.Na 2 CO 3 (4)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠: | ||||||
| ||||||
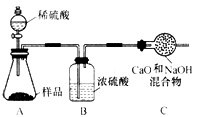
| 【含量测定】同学们为了测定该纯碱样品的纯度,设计了如下实验。 | ||||||
 |
