[化学——选修3: 物质结构与性质](15分)Sn是人类最早使用的元素之一,能形成SnCl 2 ,SnCl 4 两种氯化物,SnCl 2 常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl 4 常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。 (1)Sn元素价层电子排布式为
2019-05-22
| [化学——选修3: 物质结构与性质](15分) Sn是人类最早使用的元素之一,能形成SnCl 2 ,SnCl 4 两种氯化物,SnCl 2 常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl 4 常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。 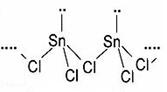 (1)Sn元素价层电子排布式为 。 (2)SnCl 2 的一维链状聚合结构如图所示,在分子结构中标出 所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。 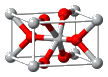 (3)SnCl 4 分子的空间构型为 ,SnCl 4 与CCl 4 中 沸点较高的是 。 (4)锡的某种氧化物的晶胞如右图,其化学式为 。 (5)解释白锡分子的密度大于灰锡的密度的原因: 。 (6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。 |