工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法该法的工艺流程为:CrO42- H+ ①转化 Cr2O72- Fe2+ ②还原 Cr3+ OH-
2019-06-24
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法
该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3
其中第①步存在平衡:2CrO42- (黄色)+2H+(g)⇌Cr2O72- (橙色)+2H2O
(1)若该平衡处于强酸性环境中,则溶液显___色.
(2)能说明第①步达平衡状态的是___.
a.Cr2O72-和CrO42-的浓度相同 b.2υ(Cr2O72-)=υ(CrO42-)
c.溶液的颜色不变 d.溶液的pH保持不变
(3)写出第②步反应的离子方程式___.
方法2:电解法
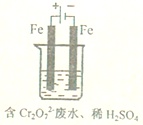
实验室用如图模拟含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)阳极的电极材料为Fe,其作用是___.
(5)溶液中同时生成的沉淀还有___,用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是___.
方法1:还原沉淀法
该法的工艺流程为:CrO42-
| H+ |
| |
| ①转化 |
| Fe2+ |
| |
| ②还原 |
| OH- |
| |
| ③沉淀 |
其中第①步存在平衡:2CrO42- (黄色)+2H+(g)⇌Cr2O72- (橙色)+2H2O

(1)若该平衡处于强酸性环境中,则溶液显___色.
(2)能说明第①步达平衡状态的是___.
a.Cr2O72-和CrO42-的浓度相同 b.2υ(Cr2O72-)=υ(CrO42-)
c.溶液的颜色不变 d.溶液的pH保持不变
(3)写出第②步反应的离子方程式___.
方法2:电解法
实验室用如图模拟含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)阳极的电极材料为Fe,其作用是___.
(5)溶液中同时生成的沉淀还有___,用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是___.