以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎Ⅱ.采用如下装置进行电化学浸出实验将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)⇌R2Cu(有机相)+2H+(水相),分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.Ⅳ.电解硫酸铜溶液制得金属铜.(1)黄铜矿粉加入
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
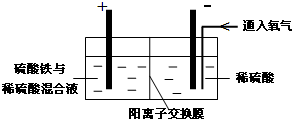
Ⅱ.采用如下装置进行电化学浸出实验将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)⇌R2Cu(有机相)+2H+(水相),分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是______.
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______.
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解.写出上述现象对应的反应式______.
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是______;加入有机萃取剂的目的是______.
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是______.
(5)步骤Ⅳ,若电解200mL 0.5mol/L的CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是______.
2019-06-24
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)⇌R2Cu(有机相)+2H+(水相),分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是______.
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______.
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解.写出上述现象对应的反应式______.
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是______;加入有机萃取剂的目的是______.
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是______.
(5)步骤Ⅳ,若电解200mL 0.5mol/L的CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是______.