某研究性学习小组查阅资料得知,漂白粉与硫酸反应可得到氯气,其化学方程式是Ca(ClO)2+CaCl2+2H2SO4 △ . 2CaSO4+2Cl2↑+2H2O.他们设计如图所示的实验装置,制备氯气并验证其性质.请回答
2019-12-02
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可得到氯气,其化学方程式是Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.他们设计如图所示的实验装置,制备氯气并验证其性质.
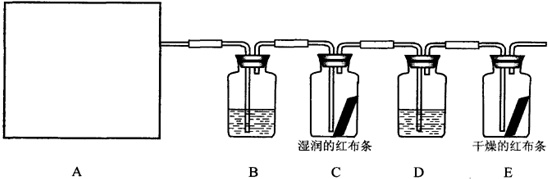
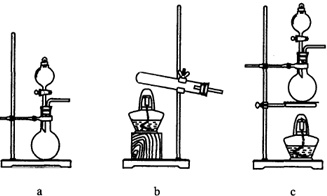
请回答下列问题.(1)实验中A部分的装置可以是___(填字母).
(2)欲验证氯气具有氧化性,B中的溶液可以是___(填字母).
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.氯化亚铁溶液
(3)观察到C中湿润的红布条褪色,E中干燥的红布条不褪色,则D中的溶液是___.
(4)此实验设计存在的明显缺陷是___.改进方法是(用离子方程式表示)___.
(5)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是___.
②漂白粉的有效成分是(填化学式)___.
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___.
| ||

请回答下列问题.(1)实验中A部分的装置可以是___(填字母).

(2)欲验证氯气具有氧化性,B中的溶液可以是___(填字母).
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.氯化亚铁溶液
(3)观察到C中湿润的红布条褪色,E中干燥的红布条不褪色,则D中的溶液是___.
(4)此实验设计存在的明显缺陷是___.改进方法是(用离子方程式表示)___.
(5)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是___.
②漂白粉的有效成分是(填化学式)___.
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___.