如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铁网,右端为一团棉花.(1)烧瓶中发生的反应的化学方程式为MnO2+4HCl(浓) △ . MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ . MnCl2+Cl2↑+2H2O,此反应的氧化剂是.(2)C中试剂是;D中试剂的作用是.(3)E中现象是;F中反应的化学方程式为2Fe+3Cl2&
2019-05-30
如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铁网,右端为一团棉花.
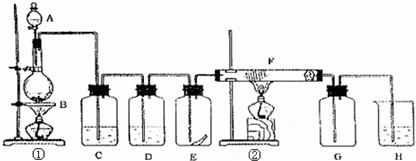
(1)烧瓶中发生的反应的化学方程式为MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
(2)C中试剂是______;D中试剂的作用是______.
(3)E中现象是______;F中反应的化学方程式为.
(4)H中试剂为______,反应的化学方程式为______.
优质解答
(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应中锰元素由MnO2+中的+4价降低到MnCl2中的+2价,所以MnO2做氧化剂,
故:答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;MnO2 ;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,所以C中试剂为饱和食盐水,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,所以D中试剂作用为吸收氯气中的水蒸气,
故答案为:饱和食盐水;吸收氯气中的水蒸气;
(3)E是收集氯气、检验氯气是否具有漂白性的实验验证,氯气无漂白性,干燥的有色布条不褪色;铁与氯气在加热条件下反应生成氯化铁,反应方程式为:2Fe+3Cl22FeCl3,
故答案为:不褪色;2Fe+3Cl22FeCl3;
(4)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH溶液;Cl2+2NaOH═NaCl+NaClO+H2O.
(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应中锰元素由MnO2+中的+4价降低到MnCl2中的+2价,所以MnO2做氧化剂,
故:答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;MnO2 ;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,所以C中试剂为饱和食盐水,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,所以D中试剂作用为吸收氯气中的水蒸气,
故答案为:饱和食盐水;吸收氯气中的水蒸气;
(3)E是收集氯气、检验氯气是否具有漂白性的实验验证,氯气无漂白性,干燥的有色布条不褪色;铁与氯气在加热条件下反应生成氯化铁,反应方程式为:2Fe+3Cl22FeCl3,
故答案为:不褪色;2Fe+3Cl22FeCl3;
(4)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH溶液;Cl2+2NaOH═NaCl+NaClO+H2O.

