2019-06-24
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌[来源:全 品…中&高*考+网] | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO 2 )进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe 3+ | Fe 2+ | Cu 2+ | Mn 2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。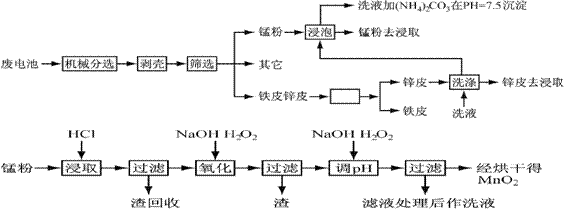
1、市售锌锰干电池为碱性电池,电解质溶液为KOH 则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH 4 ) 2 CO 3 在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H 2 O 2 后调节pH≈9的目的为将Mn 2+ 转化为MnO 2 则第一次加H 2 O 2 后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn 2+ 时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。