次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.回答下列问题: (1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.①在H3PO2中,磷元素的化合价为;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:(填化学式).②NaH2PO2是(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为③0.2mol•L-1H3PO2溶液与0.2mol•L-1NaOH溶液等体积混合后所得溶液中:c(H2P
2019-11-23
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①在H3PO2中,磷元素的化合价为___;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___(填化学式).
②NaH2PO2是___(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为___
③0.2mol•L-1H3PO2溶液与0.2mol•L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)=___mol•L-1.(溶液体积变化忽略不计)
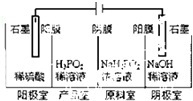
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式___
②分析产品室可得到H3PO2的原因___(用离子方程式表示)
回答下列问题:

(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①在H3PO2中,磷元素的化合价为___;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___(填化学式).
②NaH2PO2是___(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为___
③0.2mol•L-1H3PO2溶液与0.2mol•L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)=___mol•L-1.(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式___
②分析产品室可得到H3PO2的原因___(用离子方程式表示)