(2012•淄博一模)金属铜的导电性仅次于银,大量用于电气工业.(1)用金属键理论解释金属铜能导电的原因.(2)写出铜的基态原子核外电子排布式.(3)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为.(4)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体.氨分子中N原子的杂化方式为.上述深蓝色晶体中含有的化学键除普通共价键外,还有和.
 (2012•淄博一模)金属铜的导电性仅次于银,大量用于电气工业.
(2012•淄博一模)金属铜的导电性仅次于银,大量用于电气工业.
(1)用金属键理论解释金属铜能导电的原因______.
(2)写出铜的基态原子核外电子排布式______.
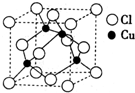
(3)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为______.
(4)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体.氨分子中N原子的杂化方式为______.上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______.
2019-04-29
 (2012•淄博一模)金属铜的导电性仅次于银,大量用于电气工业.
(2012•淄博一模)金属铜的导电性仅次于银,大量用于电气工业.(1)用金属键理论解释金属铜能导电的原因______.
(2)写出铜的基态原子核外电子排布式______.
(3)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为______.
(4)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体.氨分子中N原子的杂化方式为______.上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______.